Advanced Science | 任杰聯合劉杰教授團隊開發淋巴結外泌體靶向技術,通過免疫調控抑制腫瘤轉移
近日,我院超聲科任杰教授團隊,聯合中山大學生物醫學工程學院劉杰教授團隊,在國際知名頂級期刊Advanced Science(IF=14.3,Q1區)發表題為“Locoregional Immune Checkpoint Blockade and Remodeling of Lymph Nodes by Engineered Dendritic Cell-Derived Exosomes for Suppressing Tumor Progression and Metastasis”的研究成果。研究針對甲狀腺癌易發生淋巴結轉移及術后復發的臨床問題,提出了一種通過局部淋巴結免疫調控激發全身抗腫瘤免疫的全新策略,構建工程化外泌體局部靶向腫瘤引流淋巴結(Tumor-draining lymph nodes, TDLN),進行結內免疫檢查點阻斷及免疫微環境重塑,抑制腫瘤淋巴結轉移及遠處轉移的發生。

文章鏈接:https://doi.org/10.1002/advs.202500139
?
近年來,全球甲狀腺癌發病率呈快速上升趨勢,尤其是在女性群體中表現顯著。在中國,甲狀腺癌已成為女性第四大常見惡性腫瘤,其中最常見的是甲狀腺乳頭狀癌,然而高達30-50%的甲狀腺乳頭狀癌患者在確診時已存在頸部淋巴結轉移。[1]?由于淋巴結轉移通常提示腫瘤具有更高的侵襲、擴散風險,在這種情況下,超聲引導下射頻、微波消融治療等腫瘤微創治療方式的應用均會受到限制。即便是接受了手術治療或超聲引導下消融治療,仍有近30%的患者存在較高的淋巴結轉移復發風險。因此,如何提高腫瘤治愈率、減少術后復發轉移成為亟待解決的臨床難題。
在淋巴結轉移發生機制的相關研究中發現,腫瘤引流淋巴結(TDLN)在腫瘤免疫和轉移中發揮著重要的作用。TDLN是腫瘤發生后,攜帶腫瘤抗原的抗原呈遞細胞啟動初始T細胞并激發全身抗腫瘤免疫的最初場所,同時也是腫瘤細胞可以通過淋巴途徑播散至的最近的淋巴結。然而,相較于非引流淋巴結(NDLN)或健康淋巴結,TDLN卻常常表現為局部免疫抑制的狀態,呈現出一種轉移前生態位,能夠支持腫瘤細胞在其內定居并形成淋巴結轉移灶。而作為激發抗腫瘤免疫反應的主要場所,TDLN的免疫抑制微環境會嚴重削弱抗腫瘤免疫的產生和輸出,引起全身免疫監視功能的減弱,進一步導致腫瘤發生遠處轉移。對TDLN進行局部免疫調節并逆轉其免疫抑制狀態對于增強全身抗腫瘤免疫以及抑制腫瘤轉移是具有重要意義的,然而目前臨床上仍然缺乏能夠精準靶向淋巴結進行局部免疫調節的有效方式和策略。
為了解決上述問題,本研究構建了一種工程化樹突狀細胞外泌體(EmDEX@GA),這種外泌體具備CC-趨化因子受體7(CCR7)介導的淋巴結遷移能力、程序性細胞死亡蛋白1/程序性死亡配體1(PD-1/PD-L1)免疫檢查點阻斷和干擾素基因刺激因子(STING)信號通路激活的功能。在本研究所構建的小鼠原位腫瘤模型中,通過局部瘤內注射,EmDEX@GA能夠在CCR7的介導下主動靶向至TDLN,阻斷其內髓系免疫細胞如樹突狀細胞等過表達的PD-L1與T細胞PD-1之間的結合,激活STING信號通路,促進樹突狀細胞成熟及其抗原呈遞功能,解除對T細胞的免疫抑制,進而激發全身抗腫瘤免疫反應。經過周期性局部給藥治療后,EmDEX@GA展現了出色的抑制腫瘤淋巴結轉移和遠處轉移的效果。經過對比,由EmDEX@GA實現的局部淋巴結免疫治療對腫瘤轉移的抑制效果并不低于全身免疫檢查點阻斷治療。這些結論不僅證明了通過局部TDLN免疫微環境重塑來激發全身抗腫瘤免疫策略的可行性,也為臨床上抑制淋巴結轉移提供了新的思路和借鑒,有望被用來減緩腫瘤進展和降低分期,進一步與超聲引導下射頻、微波消融術聯合應用以擴大超聲引導下微創治療腫瘤技術的適用范圍,更徹底地消滅腫瘤,減少復發轉移。
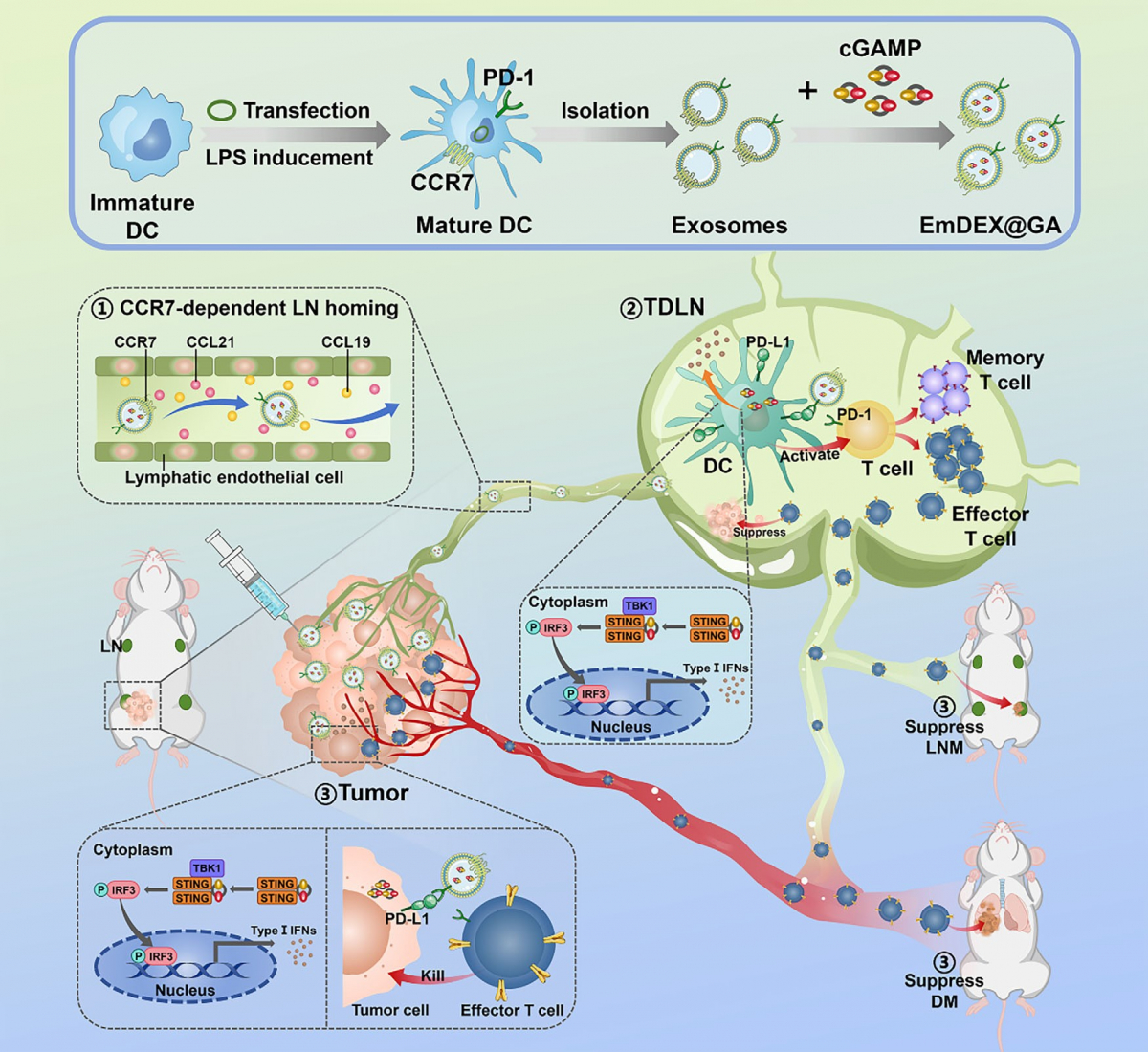
圖1 工程化外泌體EmDEX@GA的制備過程及其通過局部TDLN免疫微環境重塑抑制腫瘤進展和轉移的示意圖
?
中山大學附屬第三醫院超聲科王藝臻博士、郭曉敏博士和秦靖雅博士為本研究的共同第一作者。超聲引導下腫瘤消融治療是中山大學附屬第三醫院超聲科的優勢專業之一。任杰教授團隊在甲狀腺消融領域取得多個原創性成果,包括持續液體隔離帶法、多點平行布針法、大體積結節單次完全消融策略等,使得甲狀腺大體積結節消融療效較國際報道提高近30%。中山大學生物醫學工程學院劉杰教授團隊在水凝膠、納米載體等生物醫學材料開發領域有深厚的積累。兩個團隊在醫工結合領域發表多篇高水平學術成果,充分發揮交叉學科優勢,為超聲引導下腫瘤消融技術以及腫瘤聯合治療策略的進一步發展奠定了良好的理論基礎和臨床實踐。









