李雋、謝嬋教授團隊揭示RNF219α-CateninLGALS3信號軸促進肝癌細胞骨轉移機制
2月17日,中山大學附屬第三醫院、中山醫學院李雋教授與我院感染科謝嬋教授團隊在《Advanced Science》(2020 IF:15.8)上發表題為“RNF219/α-Catenin/LGALS3 Axis Promotes Hepatocellular?Carcinoma Bone Metastasis and Associated Skeletal?Complications”的論文,中山大學附屬第三醫院是第一作者和通訊作者單位。中山醫學院張淑霞博士、許英汝博士,我院感染科謝嬋教授為論文的第一作者,中山大學附屬第三醫院、中山醫學院李雋教授為通訊作者。該項研究成果是臨床與基礎研究交叉融合結出的又一碩果。
該論文發現肝癌細胞分泌的凝集素-3(LGALS3)通過激活破骨細胞營造骨轉移微環境,從而促進肝癌骨轉移。機制研究顯示泛素連接酶RNF219可泛素化降解α-Catenin,進而激活YAP1/?β-catenin信號通路,協同上調LGALS3表達。而維替泊芬(Verteporfin)可通過降低LGALS3表達,有效抑制肝癌骨轉移。
發生骨轉移的肝癌患者一般預后較差,臨床上一方面采用雙膦酸鹽和地諾單抗等藥物進行治療,同時采用局部治療策略減輕骨轉移造成的疼痛。但雙膦酸鹽和地諾單抗等藥物僅能防治骨質疏松和減少骨轉移相關并發癥,并不能達到治愈的效果。同時這些藥物還會導致嚴重的副作用,諸如誘發患者頜骨壞死、腎毒性、低鈣血癥以及流感樣癥狀(骨痛、發熱、疲乏、寒戰及關節或肌肉痛)。因此,揭示肝癌骨轉移的分子機制,尋找治療靶點是目前亟需解決的問題。
中山大學附屬第三醫院、中山醫學院李雋教授及謝嬋教授團隊針對這一臨床問題,采用小鼠骨轉移模型并結合臨床肝癌骨轉移組織,發現肝癌細胞分泌的LGALS3能激活破骨細胞從而營造了骨轉移前微環境的形成,進而誘導肝癌溶骨性骨轉移。進一步分子機制研究顯示,可發生骨轉移的肝癌細胞中泛素化酶RNF219高表達。RNF219可通過多泛素化機制介導ɑ-catenin降解,激活YAP1/β-catenin信號通路。進入細胞核內的YAP1及β-catenin在LGALS3啟動子上形成復合物,通過多重表觀遺傳修飾(5hmC, H4R3me2a及H3K4me3)從而轉錄上調LGALS3的表達。采用維替泊芬能阻斷LGALS3啟動子上YAP1/β-catenin復合物形成,從而降低了LGALS3表達,并有效地抑制了肝癌骨轉移。這些結果不僅闡明了肝癌骨轉移的分子機制并提供了潛在的臨床治療策略。
前期已報到凝集素-3(LGALS3)在多種惡性腫瘤中表達上調,并通過不同的細胞內和細胞外機制在癌癥進展中發揮廣泛作用。在這項研究中,該研究團隊發現肝細胞癌分泌的LGALS3能夠導致骨腔中破骨細胞/成骨細胞失衡而破壞骨穩態,這為肝細胞癌骨轉移營造了“轉移前微環境”。肝癌細胞分泌的LGALS3定位在破骨細胞祖細胞的細胞膜上,通過與胞膜蛋白CD98和整聯蛋白αvβ3形成復合物誘導破骨細胞融合和激活。這些結果證明了LGALS3在肝癌骨轉移中具有重要的作用并提示LGALS3可作為肝癌骨轉移性的預測指標。
綜上所述,這項研究提供了從多個方面的證據以證明肝癌細胞分泌的LGALS3具有促進肝癌骨轉移的生物學功能。并證明采用維替泊芬處理可通過降低LGALS3的表達而有效地抑制了肝癌骨轉移的效果。這些發現不僅增添了骨轉移前微環境形成機制,而且為預防、診斷和治療肝癌骨轉移提供新的理論依據及潛在治療策略。
自2019年12月以來,我院啟動“G2·中大”學術沙龍,為我院臨床科研人員與中山醫學院的基礎研究團隊搭建合作橋梁,本文就是雙方強強聯合的成果。我院將繼續推進“G2·中大”學術沙龍,促成臨床科研與基礎研究的互利雙贏,爭取共同產出更多造福患者的高水平研究成果。
?
?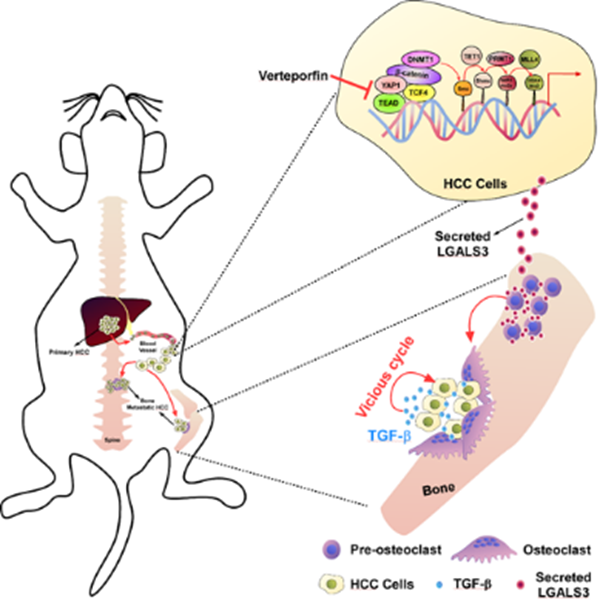
模型: 泛素連接酶RNF219介導a-catenin降解,促使YAP1/b-catenin依賴的 LGALS3啟動子的表觀遺傳修飾,導致LGALS3上調和轉移性骨疾病,維替波芬治療可能是有前景的抑制肝癌骨轉移的方法。
?
原文鏈接:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202001961









