【中心科研】中山三院邱偉/湯常永團隊解析多發性硬化(MS)認知功能障礙的發病機制
近日,中山大學附屬第三醫院腦病中心邱偉/湯常永團隊在國際知名期刊Cell Reports發表了題為“Astrocyte-derived CHI3L1 signalling impairs neurogenesis and cognition in the demyelinated hippocampus”的研究論文。該研究發現MS患者血液和腦脊液中CHI3L1的表達水平顯著升高,并與認知功能障礙相關評分存在明顯的相關性。另外,研究通過MS動物模型和體外技術等多種方法證實雙環己酮草酰二腙(cuprizone, CPZ)飲食誘導的脫髓鞘模型能顯著激活星形膠質細胞并釋放CHI3L1,抑制海馬神經干細胞的增殖分化,損害成體神經元的樹突生長、復雜性和棘突形成,進而造成海馬相關認知功能障礙。在星形膠質細胞中特異性敲除CHI3L1,可明顯減輕神經源性缺陷和認知功能障礙,而不能逆轉海馬的脫髓鞘改變。此外,機制研究表明,CHI3L1通過與CRTH2/RAGE受體結合抑制β-catenin的信號傳導,進一步導致神經發生異常和認知功能損傷。

▲原文鏈接:https://doi.org/10.1016/j.celrep.2024.114226
研究背景
多發性硬化癥(multiple sclerosis, MS)是一種免疫介導的中樞神經系統炎癥脫髓鞘疾病,主要表現為運動、感覺、認知和神經精神功能障礙。值得注意的是,超過50%的MS患者存在認知功能損傷。然而,目前的疾病修正治療(disease modifying therapy, DMT)對MS患者的認知損傷改善有限。因此,深入研究MS認知功能損傷的病理生理機制,尋找新的治療靶點進而延緩MS認知功能的下降至關重要。
研究概況
在脫髓鞘和再髓鞘海馬中,CHI3L1水平、海馬神經發生和認知功能呈動態改變:團隊首先對MS患者的血清和腦脊液進行ELISA分析,證實MS患者中CHI3L1水平明顯升高;通過對認知功能相關評分分析,發現MS患者認知功能下降與血清中CHI3L1含量成一定負相關。另外,該研究通過Chow/CPZ喂食和腹腔注射雷帕霉素(rapamycin, Rap)構建脫髓鞘和再髓鞘動物模型。結果發現:在CPZ/Rap誘導的脫髓鞘海馬中,激活的星形膠質細胞內CHI3L1的表達逐漸上調,EdU+增殖細胞、EdU+GFAP+Sox2+ 神經干細胞(neural stem cells, NSCs)和EdU+GFAP-Sox2+ 前體細胞、BrdU+DCX+未成熟神經元的細胞數量逐漸減少,神經元的樹突長度和復雜度逐漸下降,學習行為受到明顯抑制,而這些改變在再髓鞘過程中得以逆轉。結果表明,脫髓鞘增加星形膠質細胞CHI3L1的表達,阻礙海馬依賴的神經發生和認知功能,而這些影響在髓鞘再生過程中是可逆的(圖1)。
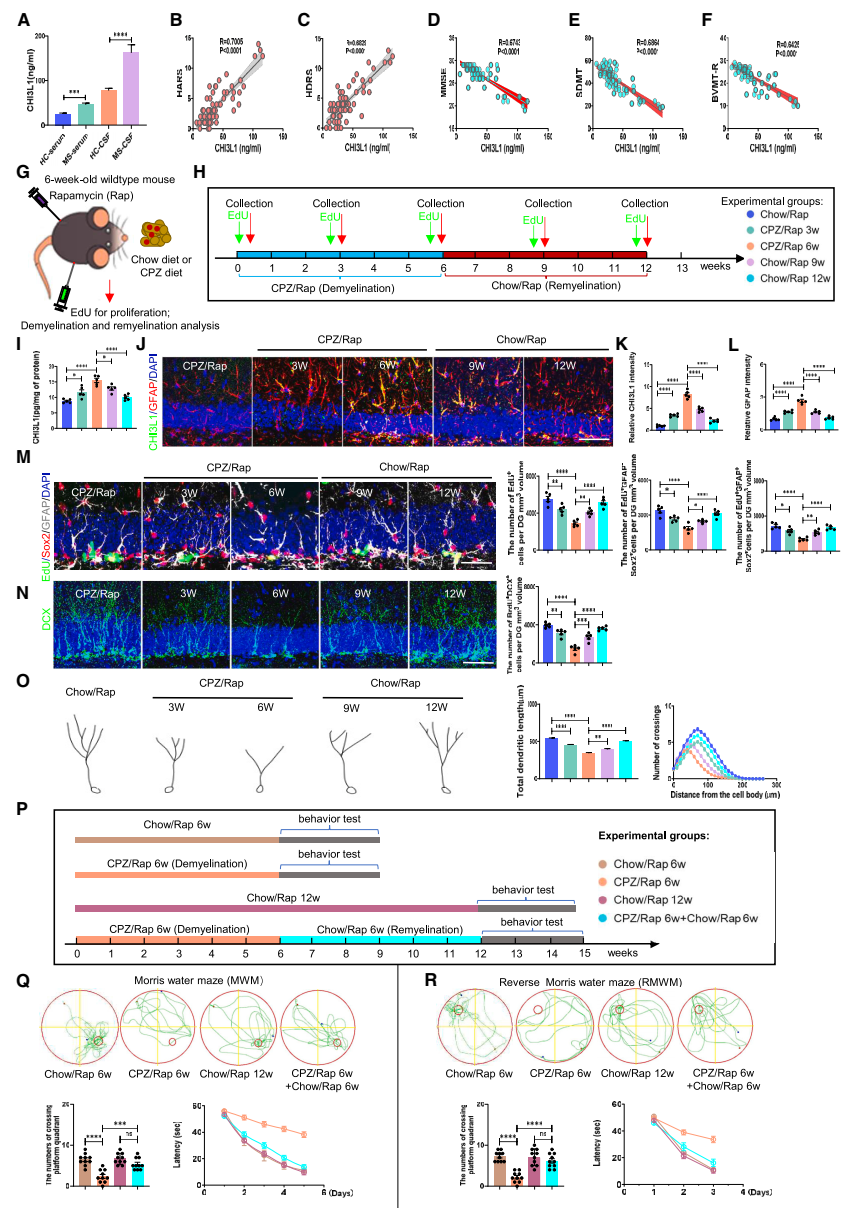
▲圖1?脫髓鞘和再髓鞘海馬中CHI3L1水平、神經干細胞的增殖和認知表現的動態改變
在脫髓鞘海馬中,神經干細胞的分化、新生神經元的發育和功能連接受到抑制:首先,團隊發現CPZ/Rap小鼠海馬內未成熟神經元(BrdU+DCX+)和成熟神經元(BrdU+NeuN+)的細胞數量均顯著減少,證實CPZ/Rap抑制了NSCs的分化。研究團隊利用腦立體定位注射技術,將標記新生神經元的RFP逆轉錄病毒注射到小鼠海馬DG中,發現CPZ/Rap處理期間,RFP+新生神經元的樹突長度和復雜性顯著減少。另外,團隊采用了一種偽狂犬病毒逆行單突觸追蹤技術評估成體新生神經元與海馬網絡之間的整合,結果發現CPZ/Rap小鼠海馬成體新生神經元的連接性受損。總之,研究證實了脫髓鞘海馬中NSCs的分化、新生神經元的發育和功能連接受到抑制(圖2)。
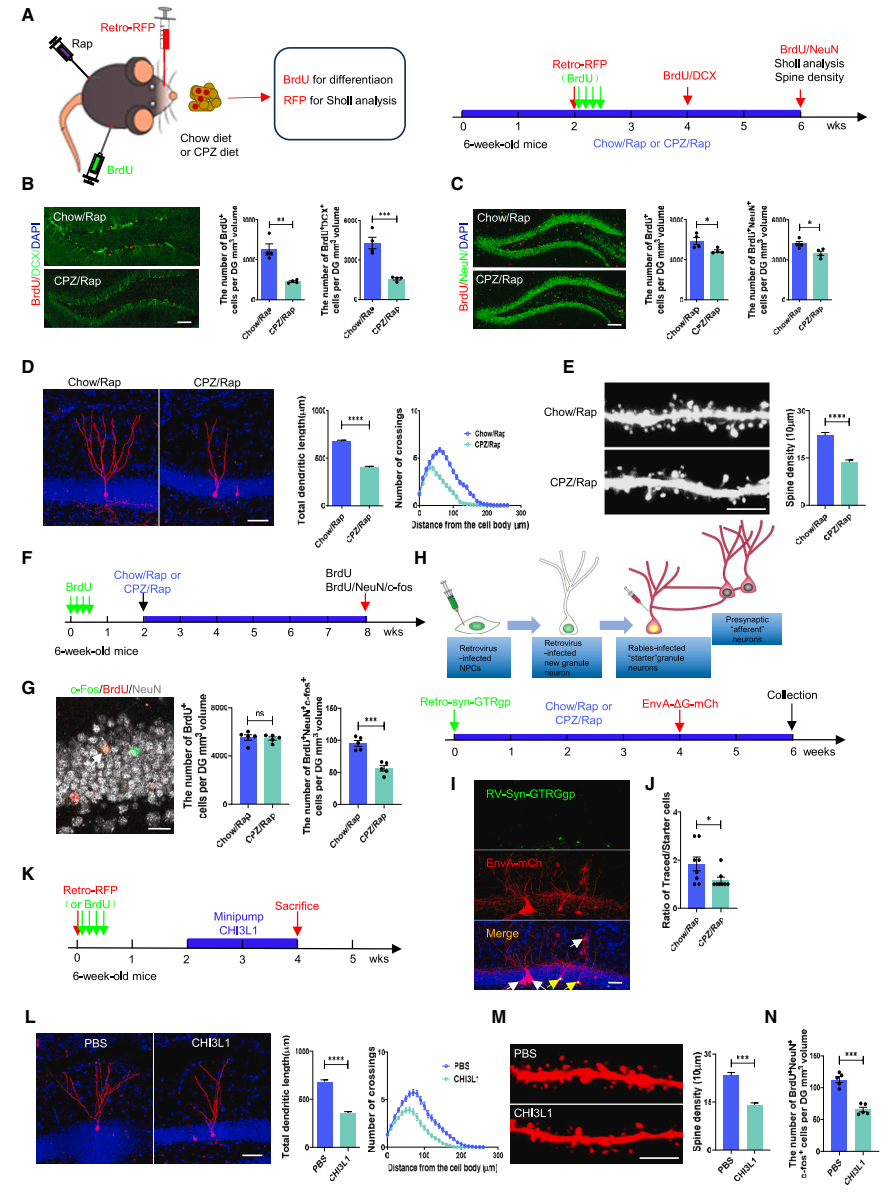
▲圖2 CPZ/Rap給藥或CHI3L1過表達對海馬新生神經元發育和功能連接的影響
星形膠質細胞內特異性敲除Chil1可改善脫髓鞘海馬的神經發生缺陷及認知功能障礙:團隊應用ALDH1L1-CreERT2;Chil flox/flox(Chil cKO)小鼠,發現Chil cKO逆轉了PZ/Rap處理對NSCs增殖分化、新生神經元發育和認知功能造成的損害作用,也就是說,星形膠質細胞內特異性敲除Chil1 能夠挽救CPZ/Rap脫髓鞘動物模型的海馬神經發生缺陷及認知功能障礙(圖3)。
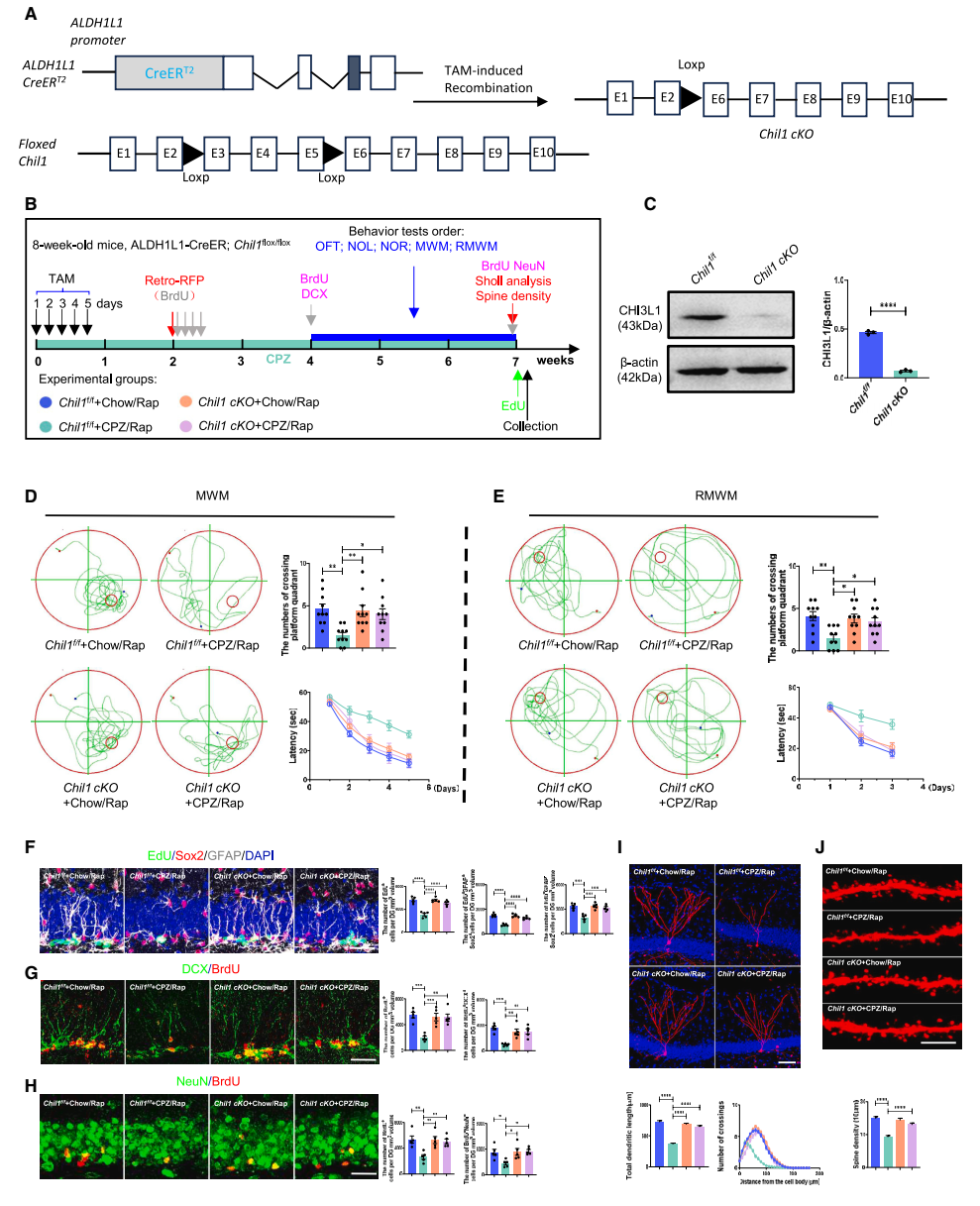
▲圖3 星形膠質細胞Chil1的缺失對CPZ/Rap小鼠成年海馬神經發生、新生神經元發育和認知功能的影響
CHI3L1與RAGE受體結合,通過減少β-Catenin信號傳導抑制海馬神經元發育:免疫熒光證實RAGE主要表達在神經元細胞上。通過逆轉錄病毒敲降新生神經元中的RAGE,研究發現敲降RAGE能挽救CHI3L1過表達和CPZ/Rap干預條件下的新生神經元發育異常。CHI3L1蛋白刺激原代海馬神經元可以明顯抑制β-catenin的表達,而利用表達shRNA的慢病毒敲除海馬神經元中RAGE后,β-catenin的表達得到了明顯恢復。因此,調控CHI3L1/RAGE/β-catenin信號通路可以改善MS小鼠模型中新生神經元的發育缺陷(圖4)。
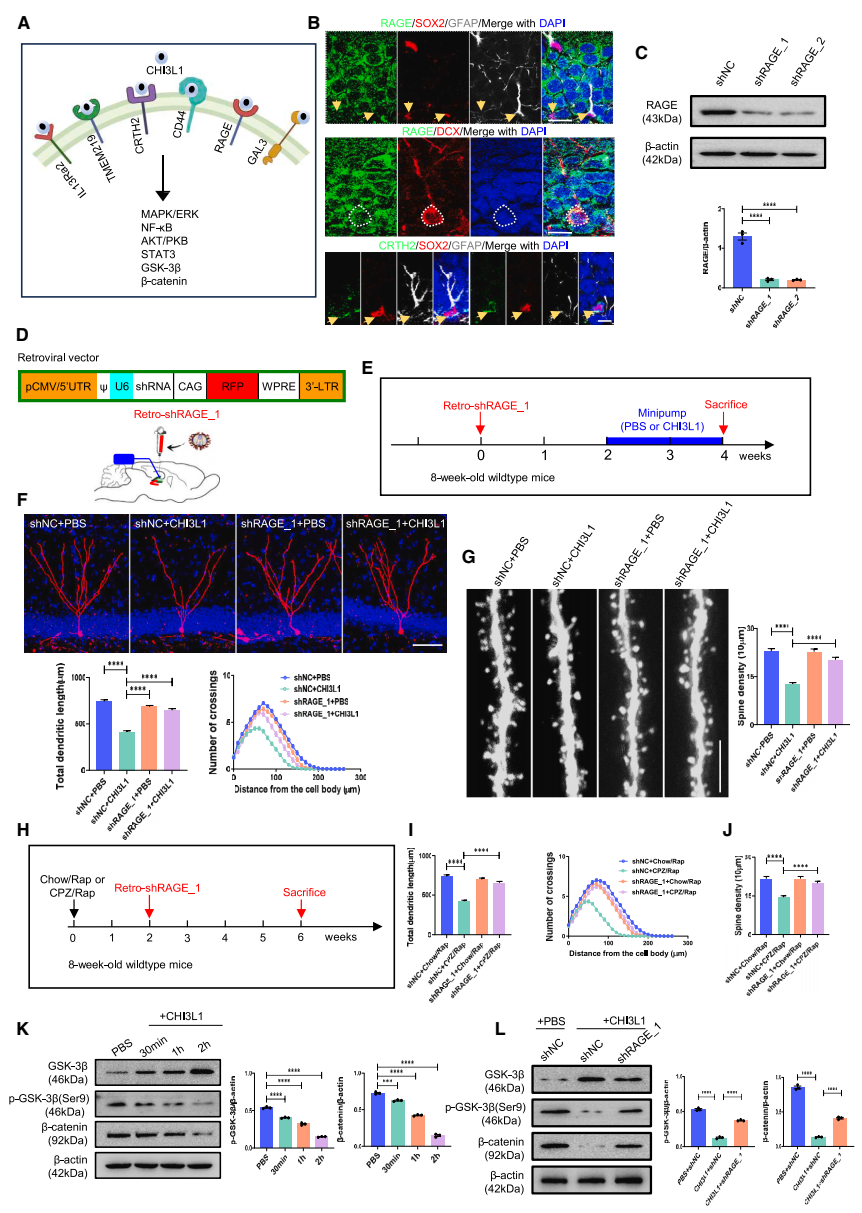
▲圖4 CHI3L1抑制海馬新生神經元發育的相關受體及下游信號通路
聯合應用CRTH2和RAGE抑制劑可挽救脫髓鞘海馬的神經發生缺陷和認知功能障礙:研究團隊發現單獨給予CRTH2抑制劑(AZD1981)僅能有效改善脫髓鞘海馬中NSCs的增殖和分化缺陷,而不能改善脫髓鞘海馬中的新生神經元發育。單獨使用RAGE抑制劑(FPS-ZM1)不能逆轉受損的NSCs增殖和分化,但可以恢復脫髓鞘海馬中的樹突和棘突發育。聯合應用CRTH2和RAGE抑制劑不僅挽救了脫髓鞘誘導下的NSCs增殖和分化異常,而且促進了脫髓鞘海馬中的樹突和棘突發育,明顯增強了脫髓鞘小鼠的認知功能(圖5)。
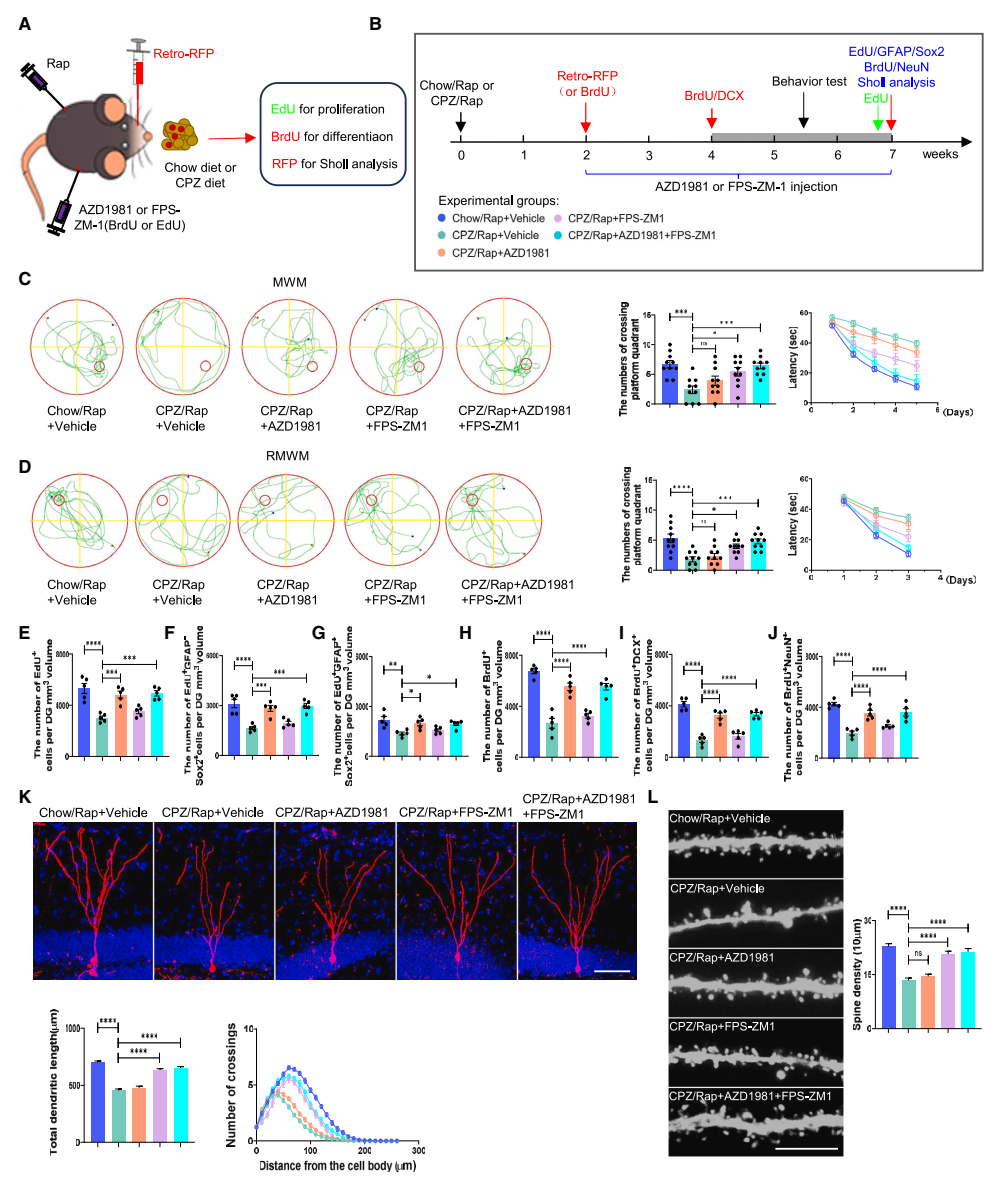
▲圖5 阻斷RAGE或/和CRTH2受體對CPZ/Rap小鼠的海馬神經發生、新生神經元的發育和認知功能的影響
抑制GSK-3β激活或激活β-catenin信號可挽救脫髓鞘海馬的神經發生和認知功能障礙:團隊發現應用GSK3β抑制劑(TWS119)和β-catenin激活劑(BML-284)都能有效抵消脫髓鞘對海馬神經發生和新生神經元發育的抑制作用,并能挽救脫髓鞘海馬的認知缺陷(圖6)。
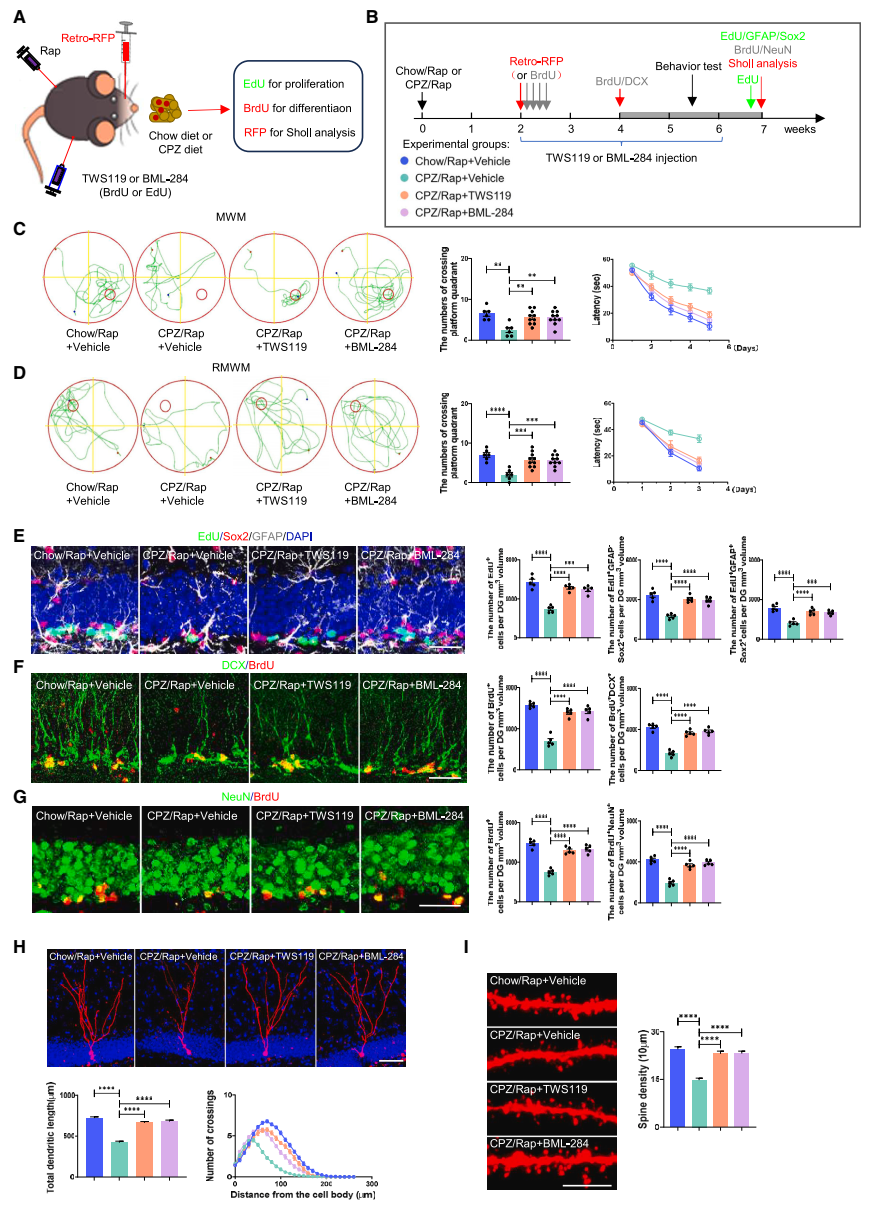
▲圖6 調控GSK3β/β-catenin信號通路對CPZ/Rap小鼠海馬神經發生、新生神經元的發育和認知功能的影響
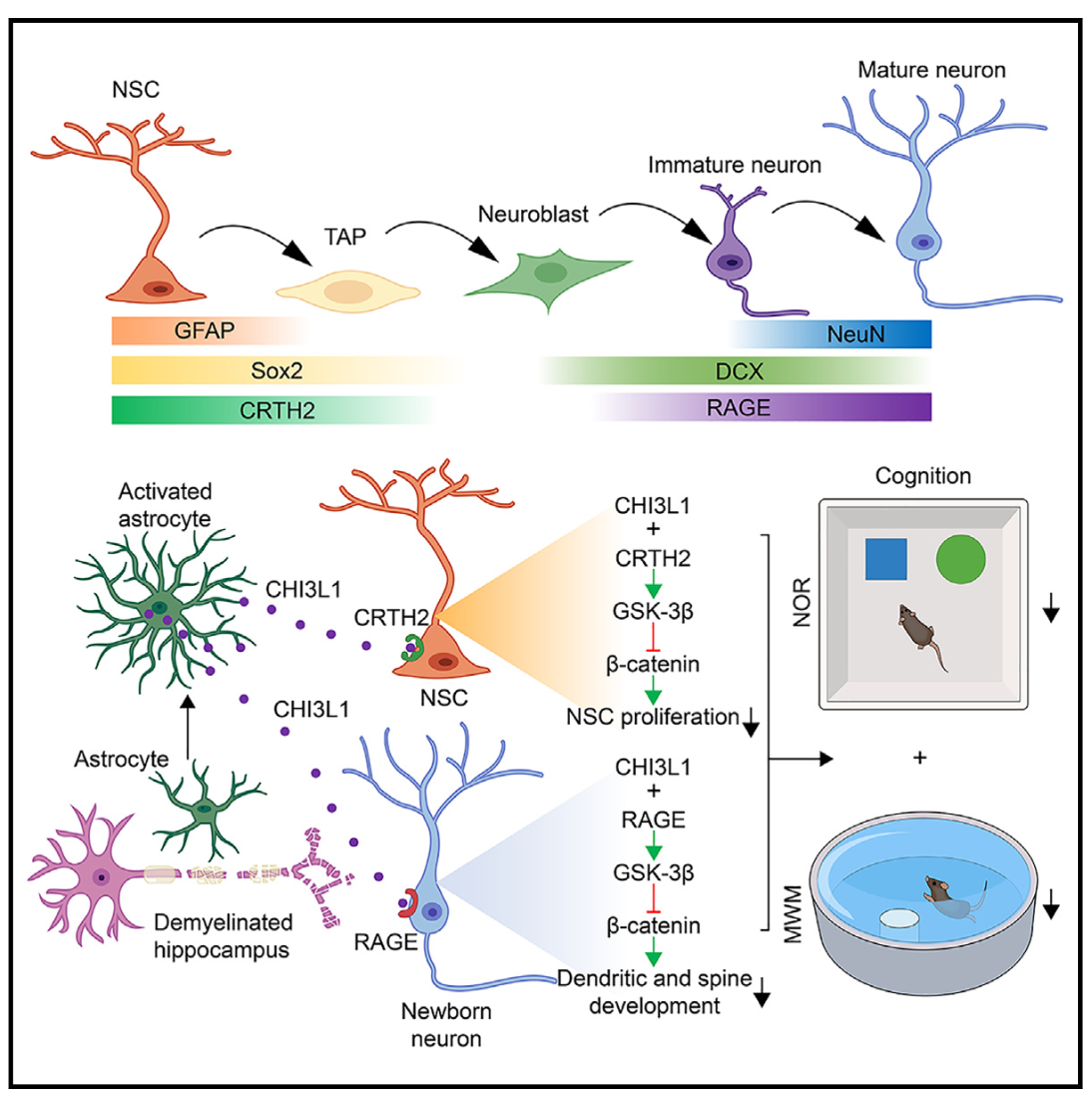
▲圖7 模式圖
研究意義
該研究證明來源于星形膠質細胞中的CHI3L1是MS患者和小鼠模型中成體神經發生缺陷及認知功能障礙的關鍵分子。星形細胞中CHI3L1的缺失可以減輕脫髓鞘小鼠的神經發生缺陷和認知功能障礙。機制研究上,CHI3L1通過與CRTH2/RAGE受體結合,抑制β-catenin信號傳導進而阻礙神經發生。該研究結果不僅深入闡明了MS相關認知功能障礙的新機制,也為改善神經系統自身免疫炎性疾病認知功能障礙提出新的研究靶點。
研究團隊
宋延娜博士、姜維博士后為共同第一作者,邱偉教授、湯常永副研究員為共同通訊作者。該研究得到了中國科學院遺傳研究所郭偉翔教授的指導。同時,該研究得到了中山大學附屬第三醫院實驗醫學部韓曉燕主任、丘秀生老師,以及廣東省科學院生物與醫學工程研究所吳彩霞教授、彭培堅工程師的支持和幫助。









